Електролитен дисоциация 1
По време на урока ще разгледаме темата "електролитна дисоциация. обмен реакция йон. " Помислете за теорията на електролитна дисоциация, и да се запознаят с определянето на електролити. Запознаят с физически и химически теория решения. Ние считаме, в светлината на теорията на електролитна определяне дисоциация на основи, киселини и соли, както и да научат как да композира уравненията на реакциите на йонообменни и се запознаят с условията на тяхното необратимост.
Относно: Решения и тяхната концентрация, дисперсни системи, електролитна дисоциация
Урок: Електролитен дисоциация. Реакционната йонообменна
1. Физични и химични теория разтвори
В зората на изучаването на електрическите явления, учените са забелязали, че токът може да се извършва не само метали, но също така и решения. Но не всички. По този начин, водни разтвори на готварска сол и други солеви разтвори на силни киселини и основи добре проводим. Оцетна киселина, въглероден двуокис и серен диоксид се извършва е много по-лошо. Но разтвор на алкохол, захар и повечето други органични съединения не провежда електрически ток.
Електрическият ток - е насочено движение на свободните заредени частици. В метали като движението се извършва от относително свободни електрони на електронен газ. Но не само метал може да осъществява електрически ток.
Електролити - са вещества, разтвори или стопилки, които провеждат електрически ток.
Nonelectrolytes - един топи вещество или решения, които не осъществяват електрически ток.
За да се опише някои проводимост разтвори трябва да се разбира, че такъв разтвор. До края на ХIХ век е имало две основни теории за решения:
· Физическо. Според тази теория, разтворът - това е чисто механична смес от компоненти, и липса на взаимодействие между частиците в него има. Тя е добро описание на свойствата на електролити, но имаше известни затруднения в описанието на електролитни разтвори.
Химическа. Според тази теория, когато разтваряне на химична реакция настъпва между разтвореното вещество и разтворителя. Това се потвърждава от наличието на термичния ефект по време на разтваряне и промяна на цвета. Например, чрез разтваряне на бяло безводен меден сулфат образува наситен син разтвор.
Истината се оказа между тези две крайни точки. А именно, в потоци разтвора и химически и физически процес.

Фиг. 1. Сванте Арениус
През 1887 г., шведската физико - химик Сванте Арениус (. Фигура 1) чрез изследване на електропроводимостта на водни разтвори предполага, че веществото в такива разтвори се разлагат на заредени частици - йони, които могат да се движат електродите - отрицателно зареден катод и положително заредена анода.
Това е причината, поради която на електрическия ток в разтвори. Този процес се нарича електролитна дисоциация (буквален превод - разделяне на разлагане под влиянието на електричество). Това име означава също, че дисоциацията се извършва под въздействието на електрически ток. По-нататъшни изследвания са показали, че това не е така: йоните са единствените носители на заряд в разтвор, а в него има независимо от тока минава през разтвора, или не. С активното участие на Сванте Arreniusa го формулира теорията на електролитна дисоциация, което често се нарича в чест на учения. Основната идея на тази теория е, че електролитите от разтворителя спонтанно се разпадат в йони. Именно тези носители на заряд са йони и са отговорни за електрическата проводимост на разтвора.
2. Основните положения на теорията за електролитната дисоциация
1. електролити в разтвор под влиянието на разтворителя на разпад на йони спонтанно. Този процес се нарича електролитна дисоциация. Дисоциация може да се осъществи и чрез разтапяне твърд електролит.
2. Йона различават от атоми в състав и свойства. Във воден разтвор, йони са в хидратирано състояние. Йоните в хидратирана състояние имат различни свойства от йони в газообразно състояние на материята. Това се обяснява по следния начин: в йонни съединения първоначално присъстват катиони и аниони. Когато разтваря молекула вода започва да се доближава заредените йони: положителния полюс - към отрицателния йон, отрицателния полюс - към положителното. Йона наречена хидратирани (фиг. 2).
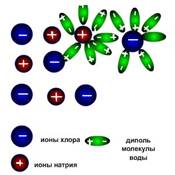
3. Разтворите или топи електролитни йони се движат хаотично, но когато електрически ток йоните се движат посоки,: катиони - катода, анионите - към анода.
3. основи, киселини, соли с оглед на теорията на електролитна дисоциация
С оглед на теорията на електролитна дисоциация може да се даде някои основи, киселини и соли като електролит.
Основи - на електролити, като в резултат на дисоциация във воден разтвор, който образува само един вид на аниони: хидроксид анион: ОН-.
NaOH ↔ Na + + ОН-
Дисоциационните бази, съдържащи няколко хидроксилни групи се извършва на етапи:
Ва (ОН) 2↔ Ва (ОН) + + ОН- първия етап
Ва (ОН) + ↔ Ва2 + + 2OH- втория етап
Ва (ОН) 2↔ Ва2 + + 2 ОН- общото уравнение
Киселина - тази електролити, като в резултат на дисоциация във воден разтвор, който образува само един вид катион: Н +. Водородни йони се нарича хидратиран протон и означават H3O +, но за простота се записва Н +.
HNO3↔ Н + + NO3-
Полиосновна киселина стъпки дисоциация:
H3PO4↔ Н + + H2PO4- първия етап
H2PO4- ↔ Н + + HPO42- втория етап
HPO42-↔ Н + + РО43- третия етап
H3PO4↔ 3H + + PO43-общото уравнение
Солите на - това електролити разпадат във водни разтвори на метални катиони и аниони на киселинната част.
Na2SO4 ↔ 2Na + + SO42-
Среден сол - това електролити разпадат във водни разтвори на метални катиони или амониеви катиони и аниони на киселинната част.
Основни соли - е електролити разпадат във водни разтвори на метални катиони и аниони хидроксид са аниони на киселинен остатък.
Киселинните соли - е електролити разпадат във водни разтвори на метални катиони, водород и катиони на анионите на киселинен остатък.
Двойни соли - е електролити разпадат във водни разтвори на няколко метални катиони и аниони на киселинната част.
Kal (SO4) 2↔ К + + Al3 + + 2SO42
Смесена сол - това електролити разпадат във водни разтвори на метални катиони и аниони на няколко остатъци
4. Силни и слаби електролити
Електролитен дисоциация до известна степен - процесът е обратим. Но чрез разтваряне на някои от равновесието на дисоциация съединения е до голяма степен изместен към дисоциираната форма. В разтвори на електролити, дисоциация се случва това е почти необратим. Ето защо, когато пишете на такива вещества дисоциация уравнения, написани или знак за равенство или права стрелка, което показва, че реакцията е практически необратими. Тези вещества се наричат силни електролити.
Наречен слаби електролити, в която дисоциация се случва съвсем леко. Когато пишете използва характер на обратимост. Таблица. 1.
За количествено определяне якостта на електролит, въведена концепцията степен elektroliticheskoydissotsiatsii на.
електролит сила може да се характеризира чрез константи химически равновесие дисоциация. той се нарича константа на дисоциация.
Фактори, влияещи върху степента на електролитна дисоциация:
· Естеството на електролита
· Концентрация електролит в разтвора
С повишаване на температурата и разреждане на разтвора се увеличава степента на електролитната дисоциация. Ето защо, за да се оцени силата на електролита може да ги сравнява само при същите условия. За стандарт, приет т = 180 ° С и с = 0,1 мол / л.
Зарежда.
Известни произведения
- Пейзажи в текста на S.Pushkina
- Анализ Blok стихотворение "В областта Kulikovom"
- Баща и син в историята Г. Олдридж "The Last Inch"
- Живота и творчеството на Гьоте VI
- Решенията на арбитражния съд. задачи
- Проектиране кетъринг дизайн закусвалня. част 2
- А. и S. S.Pushkin A.Esenin на руски характер
-
Статистика проекта