Защо е максималната валентност на елементите на 2-ри период не надвишава 4
При отговора на този въпрос, ще обясним основните понятия на химията: валентност, както и периодите на елементи. Точното определяне на валентност не съществува. Химиците го определят по различни начини:
- способността да се свързват с други атома;
- присъединяване на определен брой атоми на един елемент на други атоми;
- специални атома собственост, които влизат в химична реакция, или да се определен брой електрони.
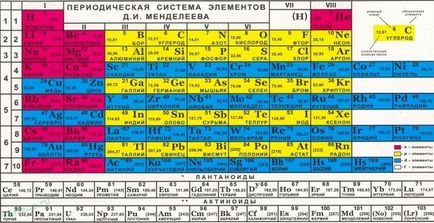
Всеки държи отчети, но е най-близо до него, но можем да кажем със сигурност: елементите на втория период могат да образуват само на определен брой химични връзки, а именно - четири. Това означава, че възможността за свързване четири атома на други елементи.
Що се отнася до периода, се определя атома възходящ последователност на ядрения заряд, и пълнене на външната обвивка електродите. Вторият период е втори ред на периодичната система, компонентите на които са осем химични елементи: бор, литий, берилий, въглерод, кислород, азот, неон.
Тези елементи на външната обвивка се състои от четири орбити. След това се анализира, ние се направят изводи, че не може да бъде по-голям от валентността на четири, като само четири несвоен електроните могат да се настанят четирима орбитали.
Формирането на валентни връзки в атома се осъществява с участието на несвоен електрони като развълнуван и не-възбудено състояние на атома. Общият брой на връзки е ограничено, а не само за елементите ние разглеждания период, както и за други представители на периодичната система. И това зависи от количеството на Орбител, че от гледна точка на разходите за енергия на тяхното образование, най-печелившите.