Устройството на батерията
Различни видове батерии за дълъг период от време и са се превърнали в част от ежедневието. Те се използват в различни електрически уреди със слаби токове, като източник на енергия. Въпреки изяви значителни разлики, устройство за батерията на всеки вид има общи характеристики и принципи. Разликите могат да бъдат само част от химикалите, с които разпределена електрическа енергия.
Типични единични батерии
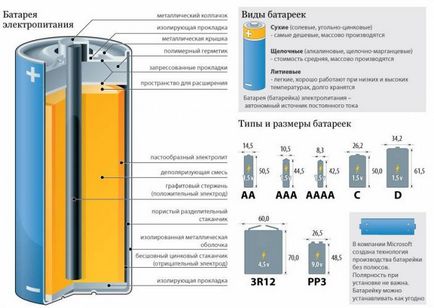
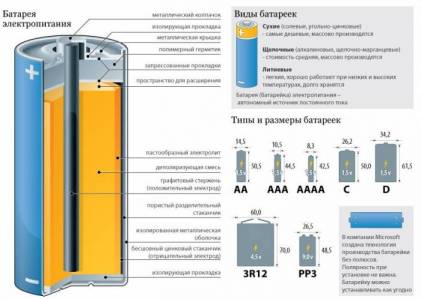
Батерията е произведен в завода, включва в структурата си няколко специални химически реагенти, които взаимодействат един с друг, изолирани

Всички реактиви са разделени от специален уплътнение, което предотвратява смесен техните съставни части. Въпреки това, тази лента може да премине електролита в батерията в течна форма. Между различни твърд реагент и течен електролит възникнат химични реакции, в резултат на образуването на положителните и отрицателните заряди. Поляритета зареждане зависи от химическия състав на реагент. Уплътнението разположен между тях, не позволява да се неутрализира положителен и отрицателен заряд.
Допълнителни елементи на батериите
За да премахнете обвинението, и то на изхода за контакти във вътрешността на анод ток колектор реагент се поставя в специален щифт. Катод токоприемник е разположен под външна втулка, която е черупката. Както настоящи колектори, се прекратяват в електрически контакти, съответно, анод и катод. Операциите започват с химическа реакция след това се случва реагенти събират разделяне и тяхното последващо прехвърляне на настоящите колектори. Накрая, таксите доставени на електродите и изолирани директно в електронното устройство.
Устройството на алкални (алкални) батерии използва цинк под формата на прах. С цел да се забави консумацията на цинк, са направени някои преди време добавка в прах химични елементи - живак и кадмий. Тъй като тези добавки са вредни, те са престанали да се прилагат. В сегашното изпълнение на батериите се използват по-скъпи, но по-малко вредни вещества, като например индий, олово и други. Както анода на реактива, използван във връзка с манганов оксид електролит, което в този случай е алкална.
Понякога могат да се появят алкални батерии. Това се случва, когато непропусклива поради възможно външни повреди на втулката, или когато вътрешното налягане става по-висока от нормалното.
Солни батерии имат сходна структура и по-ниска цена. Тяхната основна разлика е, че масата на катода се заменя със цинк жилища. Въглероден количка е в центъра. Хлорид се използва като електролит, не различна от солта на солна киселина. Че тя е служил като името на този тип батерии.