Получаване на инсулин - studopediya
Инсулин - панкреатичен хормон, който регулира въглехидратния метаболизъм и поддържане на нормална Saha-ра кръв. Недостатъкът на този хормон в организма води до един от тежки заболявания - диабет, кото-позиция като причина за смърт в трета позиция след сърдечно-съдови заболявания и рак. Инсулин - малък NY globulyar протеин, съдържащ 51 аминокиселинни остатъци и съдържащ проводим-на две полипептидни вериги, свързани чрез два дисулфидни моста. Той се синтезира като едноверижен прекурсор - препроинсулин съдържащ CON tsevoy сигнален пептид (23 аминокиселинни остатъци) и 35 улцерозен свързващ пептид (С-пептид). При отстраняване пептид-ционни сигнали в клетката на 86 образуват проинсулин аминокиселинни остатъци, в която свързва А и В веригата на инсулин С-пептид, като им с необходимата пространствена ориентация за затваряне на дисулфидни-връзки. След протеолитично люспи-среда на С-пептид се произвежда инсулин.
След откриването на инсулин през 1921 г. от Banting и най-добър, който идентифицира хормон от панкреаса на новородено теле и показа намаляване на нивата на глюкоза в кръвния серум на експериментални животни след прилагане на лекарството, то е повече от 80 години. През това време, производство на инсулин индустрия е създаден.
Обикновено панкреаса на говеда и свине не се използват в производството на месо и консервирани и-скакателната става възможно в хладилни вагони за фармацевтичен вх-среда, където се екстрахира хормон. За да се получи 100 г металната Крис-инсулин трябва да бъде 800 -1000килограма суровина. Въпреки това, този инсулин се различава по структура (аминокиселинна последователност) на човешки инсулин и използването му директно неефективно. Например свински инсулин се различава от човешкия от една аминокиселина в С-края на веригата на В (аланин вместо treonina- на), предварително извършва Следователно химична модификация на животински инсулин, за да се даде на структурата на човешки инсулин. Аланин за заместване треонин се извършва чрез ензимно-катализирано разцепване и аланин вместо защитена карбоксилна група остатък треонин prisutstvueschego присъединяване в реакционната смес в голям излишък. След отцепване на защитната О-трет.-бутилова група се получава човешки инсулин.
Развитие от средата на 1970 г., производството на рекомбинантна ДНК технология значително се промени характера на проведеното проучване в областта на генетиката, молекулярната биология и биотехнологии. Разработване на методи за промяна на генетичния апарат на клетките, което им позволява да влиза в чуждите гени, клониране тях, изрично и получаване на биосинтетичен протеин в необходимото количество даде възможност да се създаде нов клон на фармацевтичната промишленост и предоставянето на здравни различни протеинови лекарства (инсулин, еритропоетин, интерферон и т.н.)
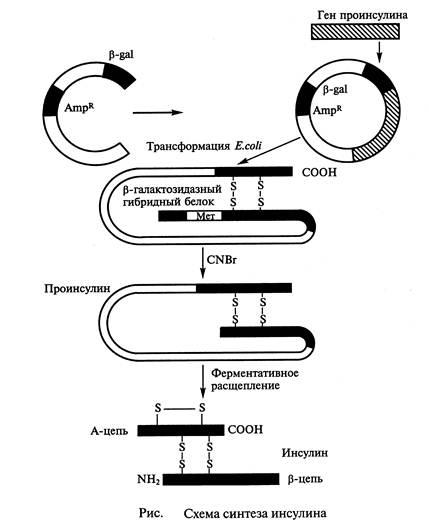
Работата по производството на генно инженерство инсулин започва преди около 20 години. През 1978 г. беше съобщено, че полученият щам на E.coli, произвеждащи плъх проинсулин (САЩ). През същата година, отделните вериги на човешки инсулин чрез експресия на синтетичния ген в клетка-кортежи E.coli, са синтезирани. Всеки от получените синтетични гени последователно регулира до 3 'ензим' края на гена (# 946; галактозидаза-Ся и се въвежда във вектор плазмид (pBR322) Клетки от Е. коли, трансформирани с такива рекомбинантни-ен плазмиди произведени GIB-борид (химерно ,. рекомбинантни) протеини, състоящи се от фрагмент # 946-галактозидаза чрез метионинов остатък, свързан с А и В вериги на инсулин. При обработка на химерния протеин ин витро с цианоген бромид пептид А-В се освобождава и след това ензимно разцепен на фрагменти А и Б. обаче приключването на дисулфидни мостове между несвързан С-пептид от инсулин А и Б единици случи с трудност, както и метода на производство на инсулин не е получил неговото развитие.
Следователно допълнително разработи метод за получаване на човешки проинсулин като цяло, с последващо превръщане в инсулин ин витро. За тази беше изкуствено синтезирани нуклеотидна последователност, кодираща структурата на проинсулин, който след това се вмъква в плазмида към 3 '' края на гена # 946-галактозидаза. Трансформираните на E.coli плазмиди такива клетки синтезират химерен протеин, състоящ се от проинсулин, фрагменти и # 946-галактозидаза, което е допълнително ин витро последователно превръща в човешки инсулин (фиг. 1).