алифатни амини
Амини - амоняк производни, в които водородните атоми са заместени с въглеводородни радикали. Амините се класифицират в зависимост от броя на водородни атоми, заместени от въглеводородни радикали. Разграничаване pervichnyeR-NH2. vtorichnyeR2-NH-N tretichnyeR3 и амини.
Известни са съединения с кватернерен азотен атом - амониева сол - R4N + Х-. В този случай, азотът носи положителен заряд.
В зависимост от вида на радикал се отличават алифатни и ароматни амини:
Мастни амини (мастни амини)
Изомерия между алифатни амини, свързани с изомерия въглеводороден радикал и заместители при азотния атом.
Много амини имат тривиални имена. За рационално амини име номенклатура образувани от въглеводородни остатъци имена, свързани с азотния атом и -амин затваряне:
изопропиламин изобутиламинът метилетиламин
Според номенклатурата IUPAC за прости амини с помощта на рационалното име. Съгласно правилата на IUPAC до име добавя към края на въглеводороден радикал амин. Въглеводородната верига започва с въглеродния атом, свързан с аминогрупата: CH3CH2CH2CH-NH-CH3 1-метилбутиламин. В присъствието на други функционални групи за амино група означена с префикса: NH2-СН2СН2-ОН - 2-аминоетанол.
Методи за получаване на алифатни амини
1. амонолиза халоалкани.
При нагряване на халоалкани с алкохолен разтвор на амоняк в запечатана епруветка, смес от съединения. В реакцията на амоняк с първични алкиламини халоалкани образуване. Monoalkylamines са по-силни нуклеофили от амоняк; допълнително те реагират с халоалкан да даде значителни количества вторични и третични амини, а дори и кватернизиран амониева сол:

Амонолиза халогениран отнася до нуклеофилни заместителни реакции. По-специално, постъпления CH3CH2Cl + NH3 Реакцията съгласно механизма:
Следователно, първични амини са обикновено получени по други начини.
2. амонолиза алкохоли.
Състои се от замяната на водородни атоми на амоняк или амин в алкиловата група. Това е важен метод за синтез на амини:
Амонолиза алкохоли прилагани в голям мащаб за синтез на нисши алифатни амини (метил и етиламино). Те се използват като гориво за ракетни двигатели с течно и като междинни съединения на органичния синтез (получаването на други амини диметилхидразин anionooobmennyh смоли и анионни вещества, пестициди, карбамати и дитиокарбамати).
3. Габриел синтез.
Габриел синтез на първични амини позволява да се освободи от един vysokoalkilirovannyh продукти. Алкилиране на фталимид механизъм калиев SN2 дава N -alkilftalimid който може лесно да се хидролизира до съответния амин:
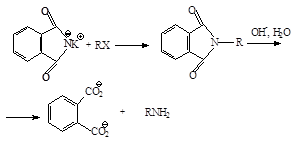
Фталимид се получава чрез нагряване на фталов анхидрид с амоняк:
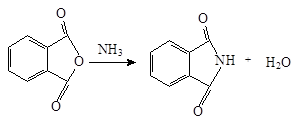
Фталимид притежава киселинни свойства, дължащи се на делокализация на отрицателен заряд на анион-имид ацил два кислородни атоми. Той губи протон, свързан с азот чрез взаимодействие с калиев хидроксид тип база. фталимид йон, образуван в тази реакция - анион което стабилизира:
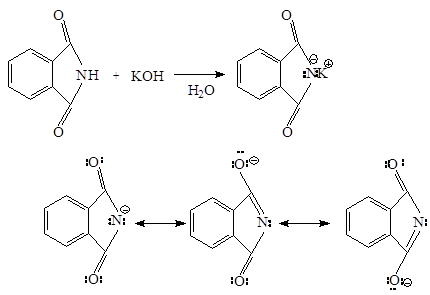
4. Редуктивно аминиране на карбонилни съединения
Много карбонилни съединения се превръщат в амини по време на процеса на възстановяване в присъствието на амоняк. Възстановяване се извършва или чрез каталитично хидрогениране или при използване на натриев цианоборхидрид NaBH3CN. Механизмът на тази реакция включва два основни етапа: образуване на имин и иминът за възстановяване на амин:
Ако вместо амоняк, използван първичен амин, реакционният продукт е вторичен амин.
5. Възстановяване на нитроалкани, оксими, нитрили, амиди
Азот-съдържащо съединение (нитроалкани, оксими, амиди, нитрили и изонитрили) под водород или други редуциращи добив или първични амини или вторичен или смес от тях:
Катализатори - Pt, Pd, Ni.
3. Отцепване на киселинни амиди (Hofmann прегрупиране).
Амиди с алифатни и ароматни карбоксилни киселини реагират с алкални разтвори на йод, бром или хлор, за да образуват първични амини. Този така наречен Hofmann реакция хипохалогенит може не само да се синтезират първични амини, но също скъси веригата на въглеродния атом.
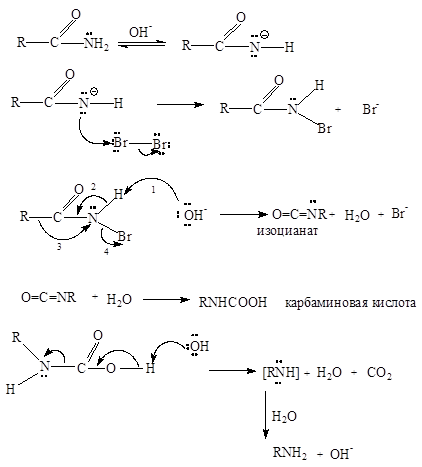
Първо резонанс стабилизиран амид йон образува N-халогениран амид (тук N-бромо амиди), който е нестабилен в алкален разтвор и се превръща в изоцианат.
Изоцианати, както и техните въглеродни аналози (ketenes) бързо реагират с вода. хидратация продукт karbaminovayakislota. лесно декарбоксилира до образуване на амин.
7. Курциус пренареждане.
киселинни хлориди, взаимодейства с натриев азид NaN3. получаване на азиди (киселинни азиди), който при нагряване, се превръщат в изоцианати:
Превръщането на ацилови азиди в изоцианати, както е показано по-долу, е координиран процес. Тази реакция се нарича Курциус пренареждане:
След това, изоцианати реагират с вода и образуват амини:
Първични и вторични амини могат да образуват междумолекулни водородни връзки. Следователно амини имат по-високи точки на кипене в неполярни съединения със същото молекулно тегло. Алкохоли и карбонови киселини образуват силни водородни връзки в амини. Тъй като третични амини не съдържат водородни атоми на азотен атом, те не образуват водородни връзки.
амини ниско молекулно тегло, се смесват с вода във всякакви пропорции.
Алифатни амини. ароматни амини
Химичните свойства на амини
1. Взаимодействие на амини с киселини
Тези соли чрез реакция с водни разтвори на основи бяха изолирани амини.
На алкалността на амините се определя от лекотата, с която разцепва амин протон от вода.
2. Алкилирането на амини с халоалкани - виж Лекция №31 .. В последния етап се образуват кватернерна амониева сол - четирите органични групи са ковалентно свързани към азота, положителния заряд е базирана на присъствие на отрицателни йони:
Кватернерни амониеви бази (бяло кристално вещество) на алкалност сравними с NaOH, КОН.
4. Ацилиране на амин (получаване на амиди).
Първични и вторични амини реагират с анхидриди и киселинни халогениди да образуват амиди:
Заместените амиди наименовани като производни на незаместени амиди на карбоксилни киселини.
Създадена в реакционната еквивалентно количество киселина се свързва нереагирал амин. Такъв метод става икономически неизгодно ако амин трудно да се синтезират или е скъп реагент. Затова често ацилира амини чрез реакция на Schotten-Baumann. който включва взаимодействие на амина и ацилиращото средство в присъствието на воден разтвор на натриев хидроксид:
Ароматни амини могат да бъдат pervichnymiArNH2 (анилин, Толуидини) vtorichnymiAr2NH (дифениламин) и tretichnymiAr3N (трифениламин).
Методи за получаване на ароматни амини
1. Възстановяване на нитросъединения (Зинин реакция).
Като редуциращи средства, използвани желязо и солна киселина или сярна киселина, калай и солна киселина, сероводород и алкални сулфиди, hydrosulfites, водород в присъствието на катализатори. Възстановяването може да се извърши и електролитно.
В зависимост от естеството на възстановяването на околната среда е различни начини. В кисела среда като междинни съединения, образувани и нитрозо хидроксиламинни производни. Последното може да се получи като краен продукт намаляването в неутрална среда. В алкална среда, процесът е по-сложно. След нитрозо съединения, получени азо, азосъединения и след това, gidrazosoedineniya и накрая амини.
2. амонолиза арилови халиди (арил халогениди алкилиране на амоняк).
Ароматни амини се получават от арил халогениди и амоняк:
Поради ниската мобилност на халоген реакцията трябва да се провежда при високи налягания и температури в присъствието на катализатори - мед и нейните соли. Само в случаите, когато - или р-позиция с халоген е силно електроотрицателна група, например, нитро, хало лесно заменен с амино група.
3. Реакция на Хофман.
Ароматни амини могат да бъдат получени от киселини чрез амид от Hofmann реакция (вж. Lektsiyu№31).
4. Получаване на вторични ароматни амини.
Ароматни вторични амини се получават чрез нагряване на ароматни аминови соли:
Средни алифатни, ароматни амини се получават чрез алкилиране на първични ароматни амини, алкохоли или халогенни производни.
5. третични амини.
Третични ароматни амини се получават чрез алкилиране или арилиране на първичен или вторичен амин:
По-малко налични третични ароматни амини получени чрез нагряване на вторични амини с арил йодиди в присъствието на меден прах:
Химичните свойства на ароматни амини
Ароматни амини имат по-слабо изразен основния характер от алифатна група. Така KB метиламин е 4,4 х 10 -5. докато анилин кб = 3,8 х 10 -10. Намаляването на алкалността на анилин в сравнение с алифатни амини обяснени чрез взаимодействие на азот свободна двойка електрони от ароматния пръстен с електрони - им свързване. Конюгиране намалява способността на неразделен електронна двойка на прикрепване на протон.
Наличието на електрон-привличащи групи в основата на намаляване на лице. Например, константата на алкалност на около -, т - и р -nitroanilinov подходящо е 1 х 10 -14. 4 х 10 -12 и 1 х 10 -12. Провеждане на втори ароматно ядро също значително намалява алкалността (за дифениламин Kb = 7,6 х 10 -14). Дифениламин форми високо хидролизиращи солеви разтвори само със силни киселини. Трифениламин основни свойства на практика не притежават.
От друга страна, въвеждането на алкилови групи (електрон-отдаваща групи) увеличава алкалността (Kb N-метиланилин и М, М-диметиланилин са съответно равни на 7,1 х 10 -10 и 10 -9 1,1 х
1. алкилиране на ароматни амини.
Ароматни амини могат да заменят водорода на амино алкили. Тази реакция води до вторични и третични амини:
Алкилиране са алкохоли или chloroalkane използвани като катализатори меден сол като амониеви комплекси. Важно е, че процесът на N- алкилиране е серия паралелни дължи на факта, че полученият амин на свой ред може да реагира с алкилиращ агент. Съставът на продуктите зависи от съотношението на реагентите.
2. Ацилирането на ароматни амини.
Действието на ацилиращи агенти (киселини, анхидриди, киселинни хлориди), водородни атоми са заместени с амино киселинни остатъци.
Ацилните производни не притежават основни свойства. Те са устойчиви на окислители и следователно се използват като междинни съединения при реакцията на амини в присъствието на окислител (например, нитриране).
3. Синтез на азометини (Шифови бази).
С леко загряване ароматен първични амини с ароматни алдехиди лесно се образуват така наречените азометини или Шифова база:
Под действието на разредена киселина Шифова база хидролизира до алдехид и амин.
4. Взаимодействие на амини с азотиста киселина.
HONO азотиста киселина нестабилни, но воден разтвор може да бъде получен чрез разтваряне на натриев нитрит при охлаждане в разредена киселина, например солна киселина.
Основни алифатни амини реагират със студен воден разтвор на азотна киселина за образуване alkildiazonievyh соли. която се образува от разлагането на смес от различни продукти:
Средни алифатни амини реагират с азотиста киселина, за да се образува N-нитрозамини жълто. Тези съединения, амиди азотиста киселина са много слаби основи.
N -nitrozodimetilamin (канцероген!)
комплекс, образуван чрез взаимодействие на смес от третични алкиламини с азотиста киселина.
Най-важните представители на ароматни амини
Анилин първо се получава чрез дестилация на индиго с вар (1826 г.). През 1842 той получава намаляването Зинин на нитробензен. Установено е, че малки количества в каменовъглен катран. Промишлено получава от нитробензол чрез каталитично хидрогениране с меден катализатор в газообразната фаза. Анилин в големи количества въпрос за цветове, циклохексиламин капролактам, пестициди и други.
р-толуидин се използва широко в производството на оцветители, особено магента.
N, N-диметиланилин се използва в производството на бои и експлозиви.